Witajcie młodzi chemicy! Gotowi na przygodę w świecie atomów?
Zaczynamy od podstaw, czyli od tego, co kryje się w środku każdego pierwiastka.
Co to jest Atom?
Wyobraźcie sobie LEGO. Z klocków budujemy różne rzeczy, prawda?
Atomy są jak takie super-małe klocki, z których zbudowana jest cała materia wokół nas. Stolik, zeszyt, a nawet Ty!
Ale atom to nie jest jednolita kulka. On sam ma swoją budowę!
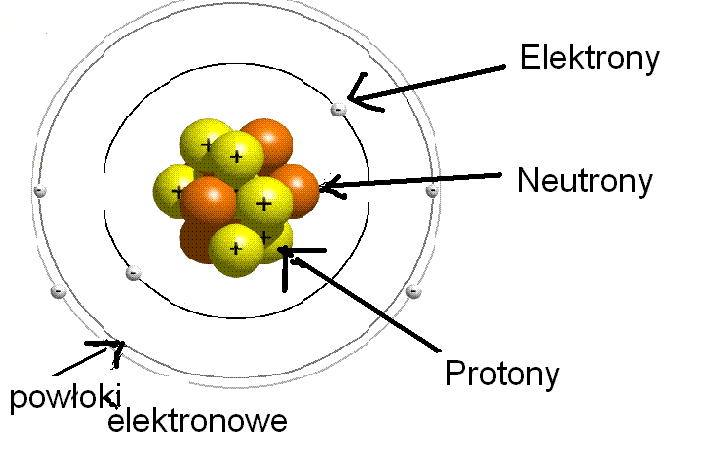
Budowa Atomu: Trzy Składniki
Atom składa się z trzech głównych części. Pomyśl o Słońcu i krążących wokół planetach.
Mamy jądro atomowe, które jest jak Słońce, i elektrony, które krążą wokół jądra jak planety.
A w samym jądrze kryją się jeszcze dwie "planety": protony i neutrony.
Protony i Neutrony: Mieszkancy Jądra
Protony to cząstki naładowane dodatnio (+). Wyobraź sobie, że są jak mali superbohaterowie, zawsze pozytywni!
Liczba protonów w jądrze atomowym decyduje o tym, jaki to pierwiastek. To tak jak numer identyfikacyjny każdego klocka LEGO!
Neutrony, z kolei, są neutralne, czyli nie mają ładunku. Są jak pokojowi mediatorzy w jądrze, utrzymujący wszystko w harmonii.
Razem, protony i neutrony tworzą masę atomową. To tak jakby zważyć całą ekipę superbohaterów i mediatorów.
Elektrony: Tancerze Wokół Jądra
Elektrony to cząstki naładowane ujemnie (-). Są bardzo małe i lekkie, w porównaniu do protonów i neutronów.
Krążą wokół jądra atomowego po tzw. orbitalach. Wyobraź sobie, że to takie specjalne trasy dla elektronów, jak autostrady.
Elektrony lubią krążyć po określonych poziomach energetycznych, czyli na różnych "autostradach" od jądra.
To, jak rozmieszczone są elektrony, decyduje o tym, jak atom zachowuje się w reakcjach chemicznych. To tak jakby klocki LEGO układały się w określony sposób, żeby zbudować coś konkretnego!
Liczba Atomowa i Masowa: Dwa Ważne Numery
Każdy pierwiastek ma dwa ważne numery: liczbę atomową i liczbę masową.
Liczba atomowa (Z) to po prostu liczba protonów w jądrze atomowym. To numer identyfikacyjny pierwiastka, jak wspomniałem wcześniej. Na przykład, węgiel (C) ma liczbę atomową 6, bo ma 6 protonów.
Liczba masowa (A) to suma liczby protonów i neutronów w jądrze atomowym. To tak jakby zważyć protony i neutrony razem. Na przykład, jeśli atom węgla ma 6 protonów i 6 neutronów, to jego liczba masowa wynosi 12.
Możemy to zapisać w symbolu pierwiastka: AZX, gdzie X to symbol pierwiastka.
Dla węgla (C) z liczbą masową 12 i liczbą atomową 6, zapis wygląda tak: 126C
Izotopy: Atomy z Inna Liczbą Neutronów
Czasami atomy tego samego pierwiastka mają różną liczbę neutronów. Nazywamy je izotopami.
Wyobraź sobie, że masz klocki LEGO, które wyglądają tak samo (mają taką samą liczbę protonów), ale niektóre są cięższe od innych (mają więcej neutronów).
Na przykład, węgiel ma dwa główne izotopy: węgiel-12 (12C) i węgiel-14 (14C). Oba mają 6 protonów, ale węgiel-12 ma 6 neutronów, a węgiel-14 ma 8 neutronów.
Izotopy mają różne właściwości, np. niektóre są radioaktywne i wykorzystuje się je w medycynie lub archeologii.
Jony: Atomy, które Zyskały lub Straciły Elektrony
Atomy czasami oddają lub przyjmują elektrony. Wtedy stają się jonami.
Jeśli atom straci elektron (ujemny ładunek), staje się jonem dodatnim, czyli kationem. Wyobraź sobie, że oddajesz komuś swój ulubiony klocek LEGO – tracisz coś, więc jesteś trochę "plusowy", bardziej otwarty.
Jeśli atom przyjmie elektron, staje się jonem ujemnym, czyli anionem. To tak jakbyś dostał nowy klocek LEGO – zyskałeś coś, więc jesteś trochę "minusowy", bardziej nasycony.
Na przykład, atom chloru (Cl) chętnie przyjmuje jeden elektron, tworząc jon chlorkowy (Cl-). A atom sodu (Na) chętnie oddaje jeden elektron, tworząc jon sodu (Na+).
Podsumowanie
Pamiętajcie: atom to super-mały "klocek", z którego zbudowany jest świat.
Składa się z jądra (protony i neutrony) i krążących wokół niego elektronów.
Liczba atomowa to liczba protonów, a liczba masowa to suma protonów i neutronów.
Izotopy to atomy tego samego pierwiastka z różną liczbą neutronów.
Jony to atomy, które zyskały lub straciły elektrony.
Teraz, gdy znacie podstawy budowy atomu, możecie ruszać na podbój chemicznych zagadek!